Califico los blogs y realizo corrección a las notas de los cuadernos
viernes, 6 de septiembre de 2019
Semana 28
Ejemplo de mecanismos de reacciones orgánicas polares y
no polares
Adición de ácido bromhídrico a un doble enlace en presencia
de peróxido, vea usted el capítulo cuarto de los alquenos más adelante


Un ejemplo de b) es el que sigue: Es una reacción de
sustitución de un hidrógeno en un alcano por un átomo “A”, que puede ser un
halógeno como cloro o bromo. (vea el capítulo tres “sobre las reacciones de los
alcanos”) Las dos reacciones que se muestran se conocen como etapa de
propagación y son las más importantes en este tipo.

Todas las reacciones por radicales libres poseen tres fases:
Una de Inicio, otra de Propagación y la última de Término.
Un esquema típico de una reacción de sustitución, es la
bromación del metano por el método de los radicales libres es:

La fase más importante en este caso, como ya se mencionó, es
la propagación, y la razón de ello es debido a que por cada molécula de
iniciador, (Br2) que se rompe, paso (A), se genera solo dos radicales libres,
en cambio en la etapa de propagación, pasos (B y C) en donde se produce la
sustitución, se repite unas 105 veces.
Por último, la fase de terminación, es aquella en la que dos
o más de los radicales activos de la reacción se encuentran generando una
partícula o molécula no activa. Esto ocurre lentamente hasta que la reacción se
detiene si no hay mayor estímulo.
Semana 26
REACCIONES
ORGÁNICAS
Las reacciones
orgánicas son reacciones químicas que involucran al menos
un compuesto orgánico como reactivo.Los tipos básicos de
reacciones químicas orgánicas son reacciones de
adición, reacciones de eliminación, reacciones de sustitución,
y reacciones redox orgánicas.En síntesis orgánica, se usan
reacciones orgánicas en la construcción de nuevas moléculas orgánicas. La
producción de muchos químicos hechos por el hombre, tales como drogas,
plásticos, aditivos alimentarios, textiles, dependen de las reacciones
orgánicas.

Ruptura de
enlaces:
Las reacciones
suponen que se lleve a cabo una ruptura de alguno de los enlaces que
intervienen en las moléculas de las sustancias que reaccionan y la reordenación
de los electrones de valencia para formar nuevos enlaces en los productos que
da la reacción. Dichas rupturas, por lo general, pueden ocurrir en dos
formas: ruptura hemolítica, y ruptura heterolítica.
Ruptura
homolítica: Tiene
lugar cuando un enlace de tipo covalente A:B se ve roto de
manera que cada uno de los átomos se queda con un electrón del par del enlace.
De esta manera, se consiguen dos radicales libres.
Dichas especies
son neutras eléctricamente hablando, poseen un electrón que se encuentra
desapareado, son bastante reactivas y cuentan con una vida media bastante
corta.
La ruptura del enlace A:B tiene
lugar así:
AB → A: + B∙
Ejemplo:
Este tipo de
ruptura suele darse en compuestos que cuentan con una baja o incluso nula,
polaridad y necesitan un suministro de energía que corresponda con la
disociación del enlace.
Por esto, para
poder iniciar la reacción a través de radicales libres se necesita un alto
aporte a nivel energético. Dicha aportación puede llevarse a cabo a través de
una vía térmica o también siguiendo un suministro de radiaciones. Estas
reacciones generalmente tienen lugar en fase o estado gaseoso, o encontrándose
en disolución con disolventes que sean no polares.
Ruptura
heterolítica:
Se realiza cuando
el enlace covalente A:B se rompe de maera que uno de los
dos átomos que forma en enlace se quede con el par de electrones de este. De
esta manera se consiguen dos iones, uno será positivo y el otro negativo.
La ruptura del
enlace A:B se sucede así : A:B → A+ +
:B- Ejemplo:

Cuando un carbono
consigue conservar los dos electrones, el ion resultante recibe el nombre
de carbanión R-, y en cambio, cuando los pierde se le
denomina carbocatión R+. Es más frecuente la formación de un
carbocatión que de un carboanión.
La ruptura
heterolítica en un enlace covalente tiende a producirse en moléculas con una
gran polaridad. Esta ruptura tiene lugar en condiciones más suaves que la
ruptura homolítica, y por lo general, se da en presencia de disolventes polares
que consiguen estabilizar a los iones.
Ya sean los
radicales libres formados a partir de la ruptura homolítica como los iones que
se dan en la ruptura heterolítica, reciben ambos el nombre de intermedios de
reacción, e intervienen de manera general en los mecanismos de las reacciones
de tipo orgánicas a modo de reactivos intermedios.
Clases de
reactivos:
Es normal en las
reacciones de la química orgánica llamar sustrato y reactivo a
las distintas sustancias que participan en las reacciones. La molécula que
reacciona, generalmente es la mayor, y se llama sustrato. Esta será atacada por
otra molécula, por lo general más pequeña, llamada reactivo, que dará lugar a
la reacción química al interaccionar con el sustrato. Dicho reactivo, puede ser
de distintas naturalezas, inorgánico, radical libre, electrófilo o nucleófilo.
– Radicales
libres
se producen
en las reacciones homolíticas, son bastante reactivos e interaccionan con otros
tipos de radicales o con moléculas de tipo neutro. Los radicales en química
orgánica se llaman primarios, secundarios o terciarios, dependiendo de la
naturaleza que tenga el carbono que cuente con el electrón no apareado. Los
radicales terciarios son los que mças estabilidad poseen, y por
lo tanto, son menos reactivos.

– Reactivos electrófilos:
Son reactivos con
alguno de sus átomos de poca densidad electrónica, por lo cual suelen actuar
sobre los átomos del sustrato que tienen carga negativa, o una alta densidad de
carga. Los reactivos electrófilos siempre son cationes u otras moléculas que
tienen algún orbital atómico sin ocupar, como por ejemplo H+, BF3, SO3, etc.
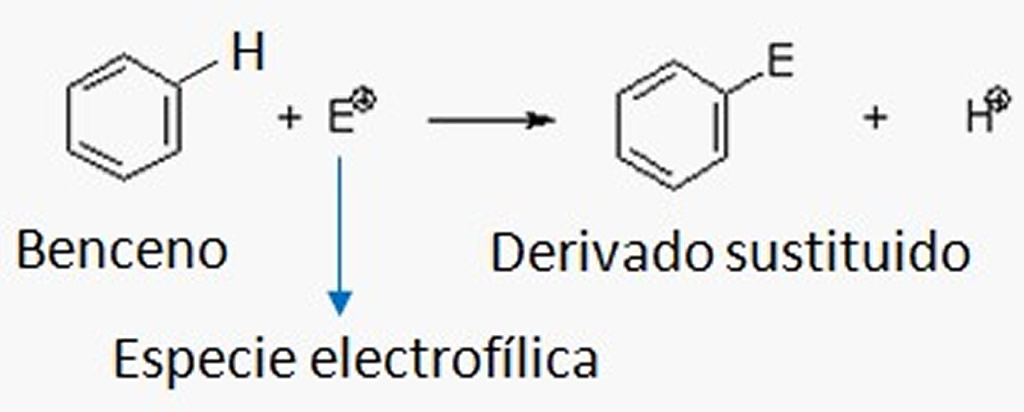
– Reactivos nucleófilos: Son
reactivos que tienen algunos de sus átomos con una alta densidad de carga, por
lo que suelen actuar en los átomos del sustrato que tenfa carga
positiva o un deficit de carga. Por lo general son aniones o neutros
con electrones libres, por lo tanto, ceden electrones. Es el caso del H-, OH-,
CN-, etc.
Principales
tipos de reacciones orgánicas:
Si tenemos en
cuenta la relación que existe entre el sustrato y los productos de la reacción,
podemos distinguir diferentes tipos de reacciones orgánicas. Destacamos las
reacciones de sustitución, de adición, de eliminación, de condensación, así
como las reacciones de polimerización.
–Reacciones de
sustitución
Son reacciones
donde un átomo o varios átomos de un reactivo se meten en la cadena de carbonos
que forma al sustrato, consiguiendo cambiar alguno de los átomos que se
encuentran unidos al carbono.
R-X (sustrato) +
Y ( reactivo) → R-Y + X
Según el tipo de
ruptura que se cree en los enlaces, la sustitución podrá ser homolítica o
heterolítica. La más frecuente es la sustitución heterolítica, la cual además
puede ser nucleófila o electrófila (SN1, SN2, E1, o E2).
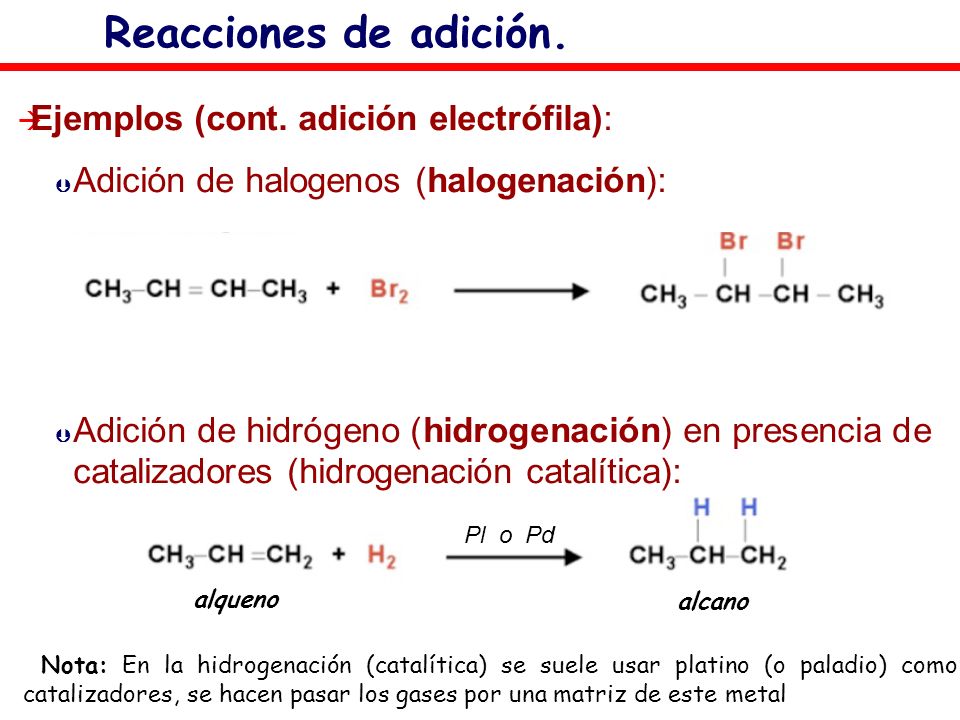
– Reacciones
de adición
Se conocen como
reacciones de adición a aquellas donde dos átomos que se encuentren unidos a
través de enlaces dobles o triples, cuando se han roto, se unen a otros tipos
de átomos a través de enlaces simples. Estas adiciones pueden ser nucleófilas o electrófilas.
– Reacciones
de eliminación
Las reacciones de
eliminación son en las cuales la molécula que forma el sustrato sufre una perdida de
dos átomos o grupos de ellos, que se encuentran enlazados a su vez a dos átomos
de carbono adjunto, formándose entre ellos un enlace tipo π. Son las reacciones
contrarias a las de adición.
– Reacciones
de condensación
Estas reacciones
suceden cuando dos o más de las moléculas orgánicas se enlazan a través de una
eliminación molecular.
–Reacciones de
polimerización
Estas reacciones
tienen una alta importancia en la práctica, pues dan lugar a la formación de
sustancias poliméricas, es decir, moléculas con un gran tamaño, resultantes de
unir muchas moléculas en una sólo, que por lo tanto será más compleja.

jueves, 5 de septiembre de 2019
Semana 25
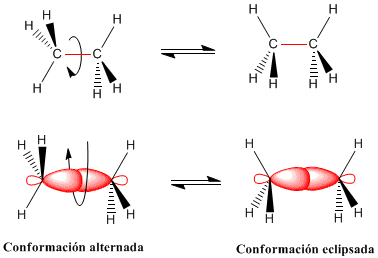
ISOMERIA CONFORMACIONAL
La libre rotación en torno a un enlace simple da lugar a que
las moléculas puedan adoptar un número infinito de distribuciones espaciales
interconvertibles recíprocamente sin ruptura de enlaces, debido a que entre los
carbonos, se encuentra un enlace sencillo o sigma (σ). Estas
disposiciones espaciales reciben el nombre genérico de conformaciones, y
las distintas conformaciones reciben el nombre de confórmeros.
Alternada: Es la más estable (menor energía) pues sus
átomos están los más separados posible y por tanto la interacción es mínima.
Eclipsada: Es la menos estable (mayor energía).
Sesgada o desviada: Se llaman así a las infinitas
conformaciones que existen entre la alternada y la eclipsada. Su energía es
mayor que la alternada y menor que la eclipsada.
La rotación del enlace carbono-carbono en el etano da lugar
a dos conformaciones límite:
-La conformaciones alternada (con los hidrógenos
alternados)
- La conformación eclipsada (con los hidrógenos enfrentados)
- El paso de la conformación alternada a la eclipsada o
viceversa se realiza por giro de 60º. Obsérvese que en un giro de 360º existen
infinitas conformaciones posibles.

Semana 24
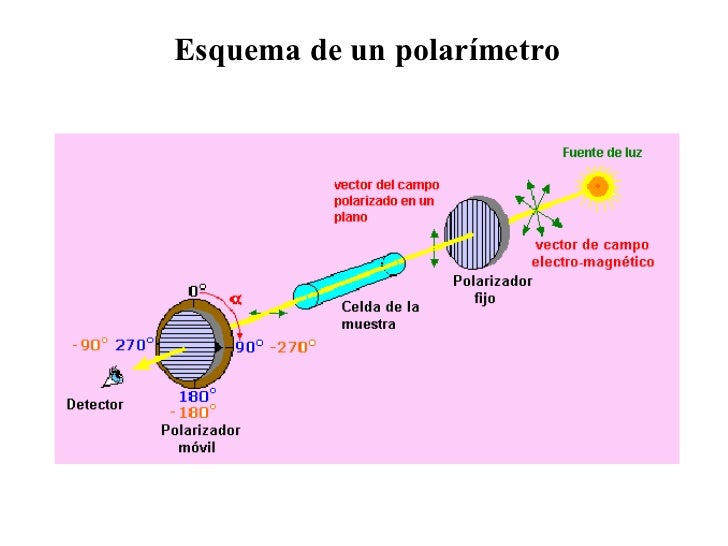
ISOMERIA OPTICA
Existen moléculas que coinciden en toda sus propiedades
excepto en su capacidad de desviar el plano de luz polarizada. Son los llamados
isómeros ópticos.
Así mismo, podemos definir enantiómero, como dos estructuras
especulares de la misma molécula, no superponibles.
Por otro lado, se conoce como diasteroisómeros, a los
isómeros ópticos que entre sí, no son enantiómeros.

Para representar los isomeros opticos se emplean las
proyecciones de fischer siguiendo los siguientes pasos:
1. La molécula se
debe escribir verticalmente colocando en la parte superior el carbono mas
oxidado (con mas oxigeno y menos hidrógeno)
2. En la estructura
solo debe aparecer los carbono quilares que los vamos a colocar en
la interpretación de la linea vertical con la horizontal.
Resultado de imagen para isomeria optica

Semana 23
ISOMEROS CIS-TRANS
La isomería cis-trans (o isomería geométrica) es un tipo de
estereoisomería de los alquenos y cicloalcanos. Se distingue entre el isómero
cis, en el que los sustituyentes están en el mismo lado del doble enlace o en
la misma cara del cicloalcano, y el isómero trans, en el que están en el lado
opuesto del doble enlace o en caras opuestas del cicloalcano.
La isomería cis-trans o geométrica es debida a la rotación
restringida entorno a un enlace carbono-carbono. Esta restricción puede
ser debida a la presencia de dobles enlaces o ciclos. Así, el 2-buteno puede
existir en forma de dos isómeros, llamados cis y trans. El isómero que tiene
los hidrógenos al mismo lado se llama cis, y el que los tiene a lados opuestos
trans.
Semana 21
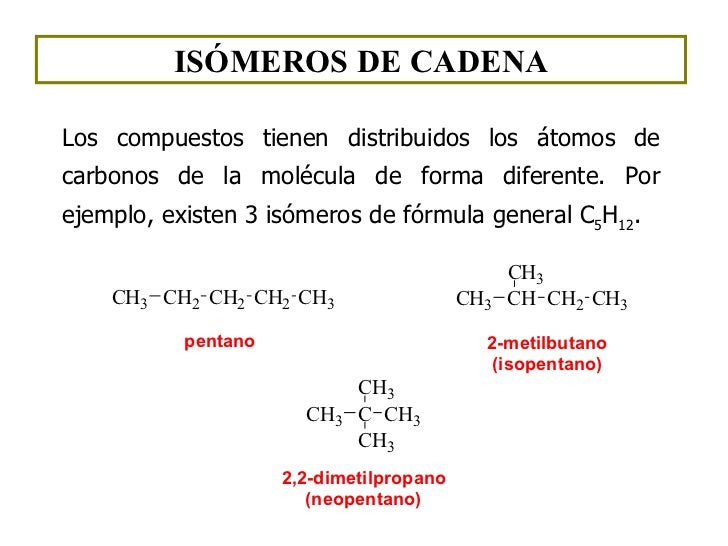
ISÓMEROS
ESTRUCTURALES
Los isómeros estructurales difieren en la forma de unir los
átomos y a su vez se clasifican en isómeros de cadena de posición y
de función.
ISÓMEROS
ESTRUCTURALES SEGÚN LA CADENA
Donde los
compuestos son los mismos pero presentan un orden distinto entre
ellos.

Como podemos ver
ambos tienen fórmulas iguales. No obstante al ver su orden vemos como
se diferencian.
ISÓMEROS
ESTRUCTURALES SEGÚN LA POSICIÓN
Los compuestos
poseen fórmulas idénticas pero la posición del primer carbono al ser reconocido
es distinta.

ISÓMEROS
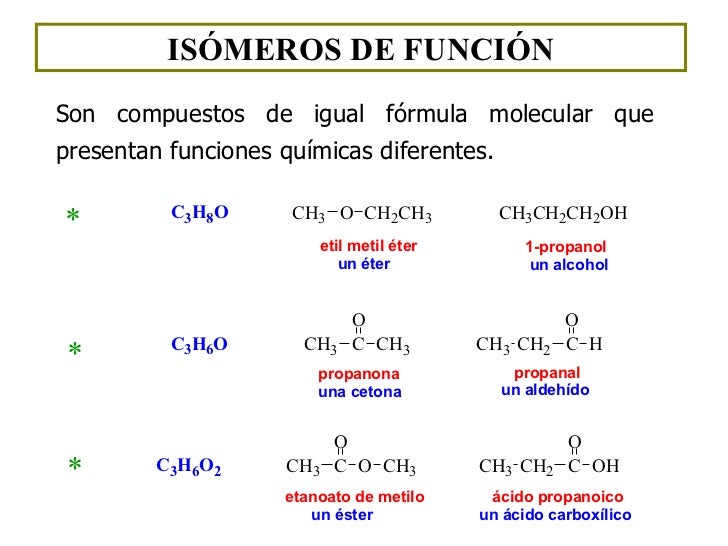
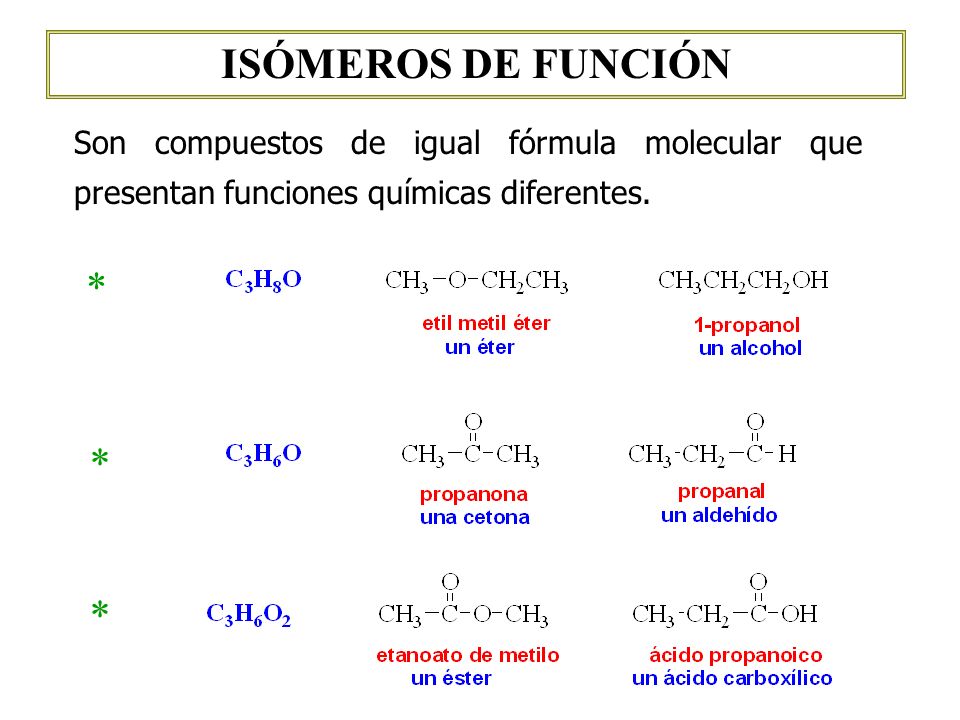
ESTRUCTURALES SEGÚN LA FUNCIÓN
Se los denomina
de esta manera porque los compuestos pueden ser de distintos grupos funcionales
sin embargo tienen la misma fórmula.
Vídeo
Suscribirse a:
Entradas (Atom)