ISOMERIA CONFORMACIONAL
La libre rotación en torno a un enlace simple da lugar a que
las moléculas puedan adoptar un número infinito de distribuciones espaciales
interconvertibles recíprocamente sin ruptura de enlaces, debido a que entre los
carbonos, se encuentra un enlace sencillo o sigma (σ). Estas
disposiciones espaciales reciben el nombre genérico de conformaciones, y
las distintas conformaciones reciben el nombre de confórmeros.
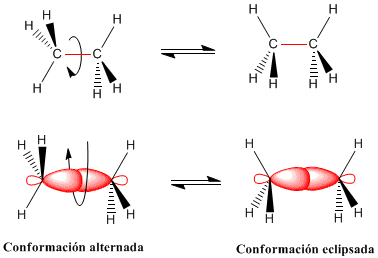
Alternada: Es la más estable (menor energía) pues sus
átomos están los más separados posible y por tanto la interacción es mínima.
Eclipsada: Es la menos estable (mayor energía).
Sesgada o desviada: Se llaman así a las infinitas
conformaciones que existen entre la alternada y la eclipsada. Su energía es
mayor que la alternada y menor que la eclipsada.
La rotación del enlace carbono-carbono en el etano da lugar
a dos conformaciones límite:
-La conformaciones alternada (con los hidrógenos
alternados)
- La conformación eclipsada (con los hidrógenos enfrentados)
- El paso de la conformación alternada a la eclipsada o
viceversa se realiza por giro de 60º. Obsérvese que en un giro de 360º existen
infinitas conformaciones posibles.

No hay comentarios:
Publicar un comentario